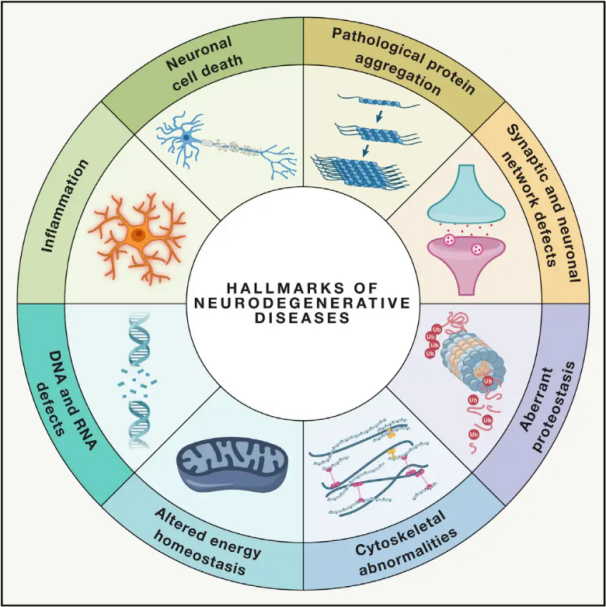
Νευροεκφυλιστικές ασθένειεςΟι NDDs χαρακτηρίζονται από την προοδευτική ή επίμονη απώλεια συγκεκριμένων ευάλωτων νευρωνικών πληθυσμών εντός του εγκεφάλου ή του νωτιαίου μυελού. Η ταξινόμηση των NDDs μπορεί να βασίζεται σε διάφορα κριτήρια, συμπεριλαμβανομένης της ανατομικής κατανομής της νευροεκφύλισης (όπως εξωπυραμιδικές διαταραχές, μετωποκροταφική εκφύλιση ή σπινοπαρεγκεφαλιδικές αταξίες), πρωτοπαθών μοριακών ανωμαλιών (όπως αμυλοειδές-β, πριόνια, tau ή α-συνουκλεΐνη) ή κύριων κλινικών χαρακτηριστικών (όπως νόσος Πάρκινσον, αμυοτροφική πλευρική σκλήρυνση και άνοια). Παρά τις διαφορές αυτές στην ταξινόμηση και την εμφάνιση των συμπτωμάτων, διαταραχές όπως η νόσος Πάρκινσον (PD), η αμυοτροφική πλευρική σκλήρυνση (ALS) και η νόσος Αλτσχάιμερ (AD) μοιράζονται κοινές υποκείμενες διεργασίες που οδηγούν σε νευρωνική δυσλειτουργία και τελικά κυτταρικό θάνατο.
Με εκατομμύρια ανθρώπους παγκοσμίως να επηρεάζονται από τις μη καταστροφικές ασθένειες (NDDs), ο Παγκόσμιος Οργανισμός Υγείας εκτιμά ότι μέχρι το 2040, αυτές οι ασθένειες θα γίνουν η δεύτερη κύρια αιτία θανάτου στις ανεπτυγμένες χώρες. Ενώ υπάρχουν διάφορες θεραπείες διαθέσιμες για την ανακούφιση και τη διαχείριση των συμπτωμάτων που σχετίζονται με συγκεκριμένες ασθένειες, αποτελεσματικές μέθοδοι για την επιβράδυνση ή τη θεραπεία της εξέλιξης αυτών των παθήσεων παραμένουν ασαφείς. Πρόσφατες μελέτες δείχνουν μια μετατόπιση στα θεραπευτικά παραδείγματα από την απλή συμπτωματική διαχείριση στη χρήση μηχανισμών προστασίας των κυττάρων για την πρόληψη περαιτέρω επιδείνωσης. Εκτεταμένα στοιχεία υποδηλώνουν ότι το οξειδωτικό στρες και η φλεγμονή παίζουν καθοριστικό ρόλο στη νευροεκφύλιση, τοποθετώντας αυτούς τους μηχανισμούς ως κρίσιμους στόχους για την κυτταρική προστασία. Τα τελευταία χρόνια, η βασική και κλινική έρευνα έχει αποκαλύψει τις δυνατότητες της Υπερβαρικής Οξυγονοθεραπείας (HBOT) στη θεραπεία νευροεκφυλιστικών ασθενειών.
Κατανόηση της Υπερβαρικής Οξυγονοθεραπείας (HBOT)
Η θεραπεία με υπερβαρικό οξυγόνο (HBOT) συνήθως περιλαμβάνει την αύξηση της πίεσης πάνω από 1 απόλυτη ατμόσφαιρα (ATA) — την πίεση στο επίπεδο της θάλασσας — για διάρκεια 90-120 λεπτών, απαιτώντας συχνά πολλαπλές συνεδρίες ανάλογα με την συγκεκριμένη πάθηση που αντιμετωπίζεται. Η ενισχυμένη πίεση του αέρα βελτιώνει την παροχή οξυγόνου στα κύτταρα, γεγονός που με τη σειρά του διεγείρει τον πολλαπλασιασμό των βλαστοκυττάρων και ενισχύει τις διαδικασίες επούλωσης που προκαλούνται από ορισμένους αυξητικούς παράγοντες.
Αρχικά, η εφαρμογή του HBOT βασίστηκε στον νόμο Boyle-Marriott, ο οποίος προϋποθέτει τη μείωση των φυσαλίδων αερίου που εξαρτάται από την πίεση, παράλληλα με τα οφέλη των υψηλών επιπέδων οξυγόνου στους ιστούς. Υπάρχει μια σειρά παθολογιών που είναι γνωστό ότι ωφελούνται από την υπεροξική κατάσταση που προκαλείται από το HBOT, συμπεριλαμβανομένων των νεκρωτικών ιστών, των τραυματισμών από ακτινοβολία, των τραυμάτων, των εγκαυμάτων, του συνδρόμου διαμερίσματος και της αεριώδους γάγγραινας, μεταξύ άλλων που αναφέρονται από την Υποθαλάσσια και Υπερβαρική Ιατρική Εταιρεία. Αξίζει να σημειωθεί ότι το HBOT έχει επίσης δείξει αποτελεσματικότητα ως συμπληρωματική θεραπεία σε διάφορα μοντέλα φλεγμονωδών ή μολυσματικών ασθενειών, όπως η κολίτιδα και η σήψη. Δεδομένων των αντιφλεγμονωδών και οξειδωτικών μηχανισμών του, το HBOT προσφέρει σημαντικό δυναμικό ως θεραπευτική οδός για νευροεκφυλιστικές ασθένειες.
Προκλινικές Μελέτες Θεραπείας Υπερβαρικού Οξυγόνου σε Νευροεκφυλιστικές Παθήσεις: Στοιχεία από το Μοντέλο Ποντικού 3×Tg
Μία από τις αξιοσημείωτες μελέτεςεπικεντρώθηκε στο μοντέλο ποντικού 3×Tg της νόσου Αλτσχάιμερ (AD), το οποίο ανέδειξε το θεραπευτικό δυναμικό του HBOT στη βελτίωση των γνωστικών ελλειμμάτων. Η έρευνα περιελάμβανε αρσενικά ποντίκια 3×Tg ηλικίας 17 μηνών σε σύγκριση με αρσενικά ποντίκια C57BL/6 ηλικίας 14 μηνών που χρησίμευαν ως ομάδα ελέγχου. Η μελέτη κατέδειξε ότι το HBOT όχι μόνο βελτίωσε τη γνωστική λειτουργία, αλλά μείωσε επίσης σημαντικά τη φλεγμονή, το φορτίο πλάκας και τη φωσφορυλίωση Tau - μια κρίσιμη διαδικασία που σχετίζεται με την παθολογία της AD.
Οι προστατευτικές επιδράσεις του HBOT αποδώθηκαν σε μείωση της νευροφλεγμονής. Αυτό αποδείχθηκε από τη μείωση του πολλαπλασιασμού των μικρογλοιακών κυττάρων, της αστρογγλίωσης και της έκκρισης προφλεγμονωδών κυτοκινών. Αυτά τα ευρήματα υπογραμμίζουν τον διττό ρόλο του HBOT στην ενίσχυση της γνωστικής απόδοσης, ενώ ταυτόχρονα μετριάζουν τις νευροφλεγμονώδεις διεργασίες που σχετίζονται με τη νόσο Αλτσχάιμερ.
Ένα άλλο προκλινικό μοντέλο χρησιμοποίησε ποντίκια με 1-μεθυλο-4-φαινυλο-1,2,3,6-τετραϋδροπυριδίνη (MPTP) για την αξιολόγηση των προστατευτικών μηχανισμών του HBOT στη νευρωνική λειτουργία και τις κινητικές ικανότητες. Τα αποτελέσματα έδειξαν ότι το HBOT συνέβαλε στην αυξημένη κινητική δραστηριότητα και τη δύναμη λαβής σε αυτά τα ποντίκια, συσχετιζόμενα με αύξηση της σηματοδότησης βιογένεσης των μιτοχονδρίων, συγκεκριμένα μέσω της ενεργοποίησης των SIRT-1, PGC-1α και TFAM. Αυτό υπογραμμίζει τον σημαντικό ρόλο της μιτοχονδριακής λειτουργίας στις νευροπροστατευτικές επιδράσεις του HBOT.
Οι μηχανισμοί του HBOT στις νευροεκφυλιστικές ασθένειες
Η βασική αρχή της χρήσης του HBOT για τις ΝΔΔ έγκειται στη σχέση μεταξύ της μειωμένης παροχής οξυγόνου και της ευαισθησίας σε νευροεκφυλιστικές αλλοιώσεις. Ο παράγοντας-1 που επάγεται από την υποξία (HIF-1) παίζει κεντρικό ρόλο ως μεταγραφικός παράγοντας που επιτρέπει την κυτταρική προσαρμογή σε χαμηλή τάση οξυγόνου και έχει εμπλακεί σε διάφορες ΝΔΔ, όπως η ΝΑ, η Πάρκινσον, η νόσος του Χάντινγκτον και η ALS, καθιστώντας τον κρίσιμο φαρμακευτικό στόχο.
Δεδομένου ότι η ηλικία αποτελεί σημαντικό παράγοντα κινδύνου για πολλαπλές νευροεκφυλιστικές διαταραχές, η διερεύνηση της επίδρασης του HBOT στη νευροβιολογία της γήρανσης είναι ζωτικής σημασίας. Μελέτες έχουν δείξει ότι το HBOT μπορεί να βελτιώσει τα γνωστικά ελλείμματα που σχετίζονται με την ηλικία σε υγιή άτομα μεγαλύτερης ηλικίας.Επιπλέον, ηλικιωμένοι ασθενείς με σημαντικές διαταραχές μνήμης εμφάνισαν γνωστικές βελτιώσεις και αυξημένη εγκεφαλική ροή αίματος μετά από έκθεση σε HBOT.
1. Επίδραση του HBOT στη φλεγμονή και το οξειδωτικό στρες
Το HBOT έχει καταδείξει την ικανότητά του να ανακουφίζει τη νευροφλεγμονή σε ασθενείς με σοβαρή εγκεφαλική δυσλειτουργία. Έχει την ικανότητα να μειώνει τις προφλεγμονώδεις κυτοκίνες (όπως η IL-1β, η IL-12, ο TNFα και η IFNγ) ενώ αυξάνει τις αντιφλεγμονώδεις κυτοκίνες (όπως η IL-10). Μερικοί ερευνητές προτείνουν ότι τα αντιδραστικά είδη οξυγόνου (ROS) που παράγονται από το HBOT προκαλούν διάφορες ευεργετικές επιδράσεις της θεραπείας. Κατά συνέπεια, εκτός από την εξαρτώμενη από την πίεση δράση μείωσης των φυσαλίδων και την επίτευξη υψηλού κορεσμού οξυγόνου στους ιστούς, τα θετικά αποτελέσματα που συνδέονται με το HBOT εξαρτώνται εν μέρει από τους φυσιολογικούς ρόλους των παραγόμενων ROS.
2. Επιδράσεις του HBOT στην απόπτωση και τη νευροπροστασία
Έρευνες έχουν δείξει ότι το HBOT μπορεί να μειώσει τη φωσφορυλίωση της πρωτεϊνικής κινάσης που ενεργοποιείται από μιτογόνο p38 (MAPK) στον ιππόκαμπο, βελτιώνοντας στη συνέχεια τη γνωστική λειτουργία και μειώνοντας τη βλάβη στον ιππόκαμπο. Τόσο το HBOT αυτόνομα όσο και σε συνδυασμό με εκχύλισμα Ginkgo biloba έχει βρεθεί ότι μειώνει την έκφραση του Bax και τη δραστικότητα της κασπάσης-9/3, με αποτέλεσμα μειωμένα ποσοστά απόπτωσης σε μοντέλα τρωκτικών που προκαλούνται από aβ25-35. Επιπλέον, μια άλλη μελέτη κατέδειξε ότι η προ-προετοιμασία του HBOT προκάλεσε ανοχή έναντι της εγκεφαλικής ισχαιμίας, με μηχανισμούς που περιλαμβάνουν αυξημένη έκφραση SIRT1, παράλληλα με αυξημένα επίπεδα λεμφώματος 2 Β-κυττάρων (Bcl-2) και μειωμένη ενεργή κασπάση-3, υπογραμμίζοντας τις νευροπροστατευτικές και αντι-αποπτωτικές ιδιότητες του HBOT.
3. Επίδραση του HBOT στην κυκλοφορία του αίματος καιΝευρογένεση
Η έκθεση των ατόμων σε HBOT έχει συσχετιστεί με πολλαπλές επιδράσεις στο κρανιακό αγγειακό σύστημα, όπως η ενίσχυση της διαπερατότητας του αιματοεγκεφαλικού φραγμού, η προαγωγή της αγγειογένεσης και η μείωση του οιδήματος. Εκτός από την παροχή αυξημένης παροχής οξυγόνου στους ιστούς, το HBOTενισχύει τον αγγειακό σχηματισμόενεργοποιώντας παράγοντες μεταγραφής όπως ο αγγειακός ενδοθηλιακός αυξητικός παράγοντας και διεγείροντας τον πολλαπλασιασμό των νευρικών βλαστικών κυττάρων.
4. Επιγενετικές επιδράσεις του HBOT
Μελέτες έχουν αποκαλύψει ότι η έκθεση ανθρώπινων μικροαγγειακών ενδοθηλιακών κυττάρων (HMEC-1) σε υπερβαρικό οξυγόνο ρυθμίζει σημαντικά 8.101 γονίδια, συμπεριλαμβανομένων τόσο των αυξημένων όσο και των μειωμένων εκφράσεων, υπογραμμίζοντας μια αύξηση στην γονιδιακή έκφραση που σχετίζεται με τις οδούς αντιοξειδωτικής απόκρισης.
Σύναψη
Η χρήση του HBOT έχει σημειώσει σημαντική πρόοδο με την πάροδο του χρόνου, αποδεικνύοντας τη διαθεσιμότητα, την αξιοπιστία και την ασφάλειά του στην κλινική πράξη. Ενώ το HBOT έχει διερευνηθεί ως θεραπεία εκτός ενδείξεων για τις μη καταγεγραμμένες ασθένειες και έχει διεξαχθεί κάποια έρευνα, εξακολουθεί να υπάρχει πιεστική ανάγκη για αυστηρές μελέτες για την τυποποίηση των πρακτικών HBOT στη θεραπεία αυτών των παθήσεων. Περαιτέρω έρευνα είναι απαραίτητη για τον προσδιορισμό των βέλτιστων συχνοτήτων θεραπείας και την αξιολόγηση της έκτασης των ευεργετικών επιδράσεων για τους ασθενείς.
Συνοπτικά, η διασταύρωση του υπερβαρικού οξυγόνου και των νευροεκφυλιστικών ασθενειών καταδεικνύει ένα πολλά υποσχόμενο όριο στις θεραπευτικές δυνατότητες, γεγονός που δικαιολογεί τη συνεχή διερεύνηση και επικύρωση σε κλινικό περιβάλλον.
Ώρα δημοσίευσης: 16 Μαΐου 2025

